قلیاییت یکی از پارامتر هایی است که در شیمی آب اندازه گیری می شود. قلیائیت کل (Total Alkalinity) اغلب با pH و کلماتی مانند قلیایی و غیره اشتباه گرفته میشود. بسیاری از متخصصان می توانند قلیائیت را با انجام آزمایش T.Alk اندازه گیری کنند، اما ممکن است حتی ندانند که واقعا چیست، چه کاری انجام می دهد و چرا مهم است؟!!
تعریف قلیائیت (Alkalinity):
آب خالص با pH=7 تعادل کامل هیدروژن را در خود دارد. مولکول های آن (H2O) به مقدار مساوی از یون های هیدروژن و هیدروکسید تجزیه می شوند که واکنش آن به این صورت است: –H2O ⇌ H+ + OH
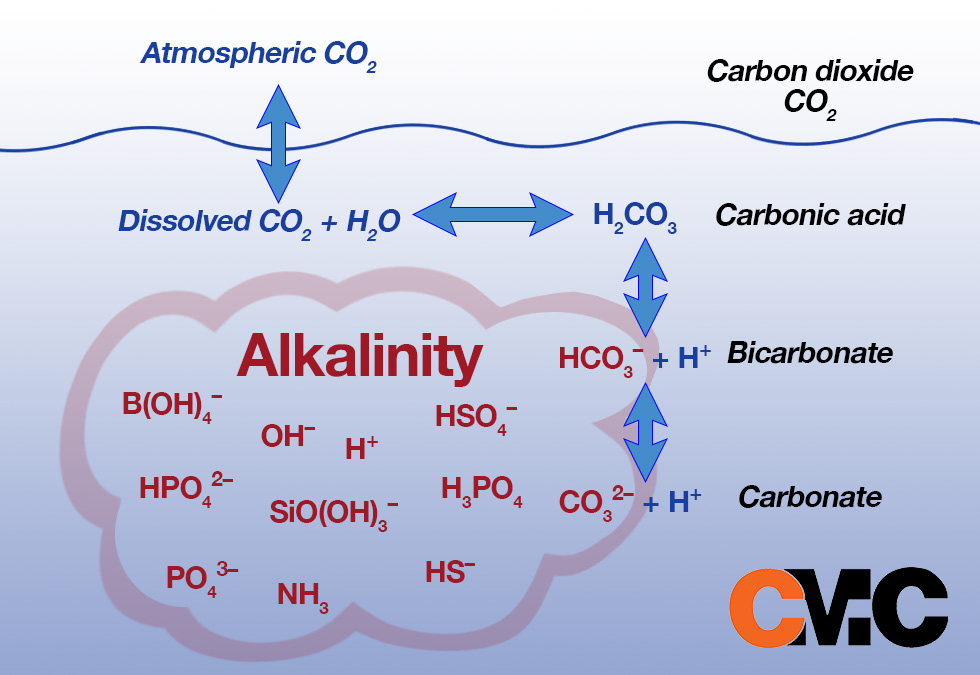
بسته به pH آب، قلیاییت می تواند به سه شکل یون های کربنات، بی کربنات و هیدروکسید(CO3-HCO3-OH) در آب وجود داشته باشند که به مجموع این سه یون قلیاییت کل گفته می شود. دلیل وجود یون های قلیاییت در آب بویلر به دو عامل وجود یون های ذکر شده در آب ورودی به بویلر و همچنین استفاده از مواد اضافه کننده قلیاییت بر می گردد.
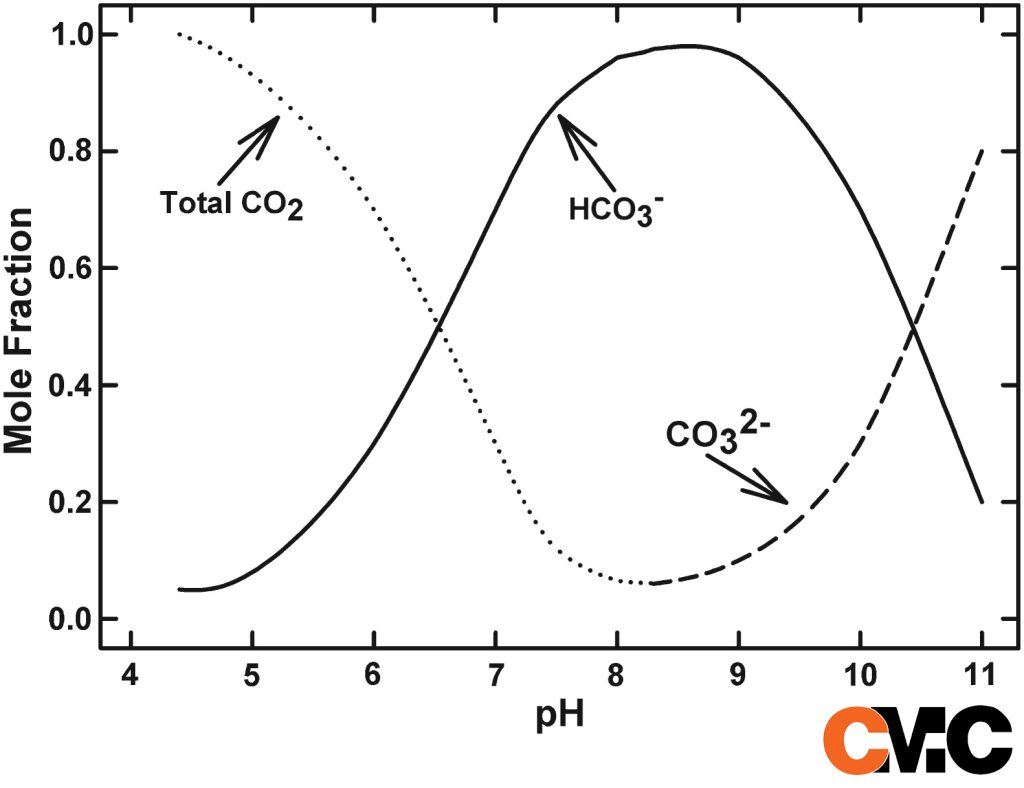
pH 4.3 نقطه ای است که قلیاییت در آب شروع می شود. در PH کمتر از 4.3 ، قلیاییت در آب وجود ندارد و فقط CO2محلول در آب (اسید کربنیک) است. اساساً در pH 4.3، اسید کربنیک شروع به تبدیل به یون های بی کربنات می کند که اصطلاحا به آن قلیاییت متیل میگوئیم.
وقتی به pH 8.3 می رسیم یونهای کربنات خود را نشان میدهند و انتقال از بیکربنات به یونهای کربنات رخ میدهد. هیدروکسید های محلول حدود 11-12 pH بوجود می آیند. بنابراین همانطور که می بینید، pH گونه (و درصد هر گونه) قلیاییت موجود در آب را کنترل می کند.
با سلام
چطور میتونیم قلیائیت یک نمونه آب رو اندازه بگیریم؟؟
با سلام
تست قلیائیت( Total alkanity) باید روی نمونه مورد نظر انجام شود.
خیلی مفید بود.
مفید و کاربردی ، ممنونم از اطلاعات خوبتون 🌹
با تشکر از مطالب مفید و کاربردی شما🙏